2020年6月3日,吉林天成制药有限公司《复方脑肽节苷脂安全性集中监测项目齐齐哈尔市中医医院启动会》在我院南院召开。科教部、药学部相关负责人及核心成员出席了本次会议。复方脑肽节苷脂注射液上市后临床安全性集中监测,是药学部首次参与的GCP机构(药物临床试验机构)药品监测项目,旨在为临床提供安全、有效、优质、稳定的药品服务。

开展药品上市后的再评价,关键是对上市药品进行安全风险预警和研判。任何一种药品必须在上市前经过严格、可靠的临床研究才能获批上市,但上市后的药品并非完全安全。药品研发者在药品上市前收集到的可能存在的药品不良反应信息是不完整的,而且在实际临床用药过程中不合理用药现象的严重性也决定必须进行上市后再评价工作。近百年来发生约40起重大件告诫人们:药品上市前的相关研究并不能完全保证药品的安全性,还应在药品上市后继续展跟踪研究,并对其安全性和有效性进行再评价。对药品上市前潜在的、没被人们发现的不良反应、特殊人群的用药评价和药品远期疗效的评价,都必须通过药品上市后再评价来完成。因此,药品上市并不意味着药品临床评价的终结,而是在临床实践、大样本人群的更为宽泛的应用,接受社会性考查的开始。
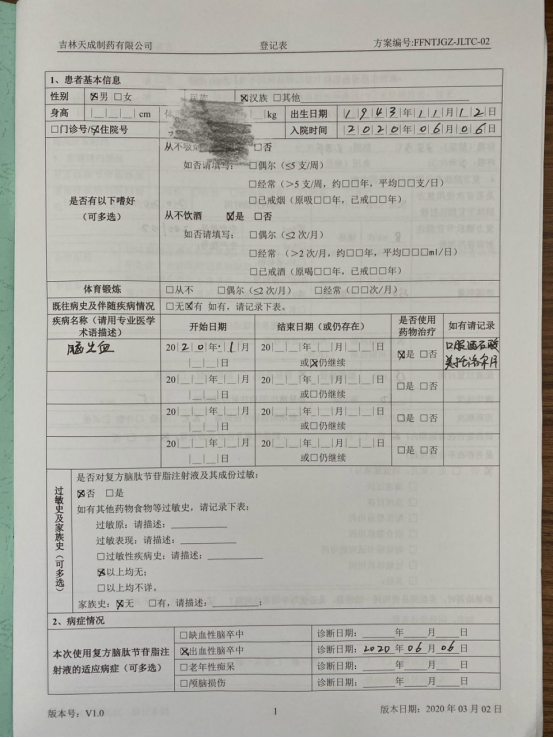
药学部的临床药师为此次项目的监测主体,药品上市后再评价属于临床试验的一类,这就要求临床药师严格坚持实事求是的科学态度,如实记录患者全部临床数据,为监测药品提供全面准确的循证证据。才能保障上市后再评价能更广泛、更系统、更全面地了解药品不良反应/不良事件发生情况、影响因素和临床应用情况;能更正确评价药品的安全性及有效性;并且根据研究结论督促生产企业改进生产工艺,修改说明书,为临床诊疗指南的完善提供依据,为临床合理用药提供前提保障。
